


2023年6月,瑞思德联合辽宁师范大学、辽宁医科大学在《Steroids》上发表了题为“雌激素受体变体ER-α36的定位与胶质母细胞瘤的侵袭有关”的研究论文。今天我们来为大家解读这篇研究论文。

胶质母细胞瘤(Glioblastoma, GBM)是最常见的中枢神经系统肿瘤,预后不良。近几十年来,GBM死亡率没有显著改善。ER-α36是ER-α66的一种变体,主要表达于质膜(~50%)和细胞质(~ 40%),少量表达于细胞核(~10%)。ER-α36的定位与恶性肿瘤有关。ER-α在中枢神经系统中参与多种神经元细胞的神经保护和对抗多种神经退行性疾病,可能在几种肿瘤的他莫昔芬(tamoxifen, TAM)耐药中起重要作用。作者实验室此前发现表达ER-α36增加了GBM对TAM的抗性。ER-α36在许多细胞中介导雌激素刺激的MAPK/ERK和PI3K/AKT信号通路的激活。因此,靶向ER-α36有可能有效抑制雌二醇(E2)介导的GBM细胞生长。
淫羊藿苷是淫羊藿属植物的一种戊烯基类黄酮衍生物,中药已经使用了几个世纪。最近的研究表明,淫羊藿苷对GBM、肾癌、肝癌、肺癌、白血病等恶性肿瘤均有疗效。SNG162是一种临床前验证的淫羊藿苷类似物,通过靶向ERα36的异常活性来抑制乳腺癌生长。作者实验室首先报道了ER-α36在GBM细胞U87中高表达,SNG162抑制U87细胞的生长。
本研究采用2D和3D体外培养模型探究SNG162对GBM细胞ER-α36的表达调控。
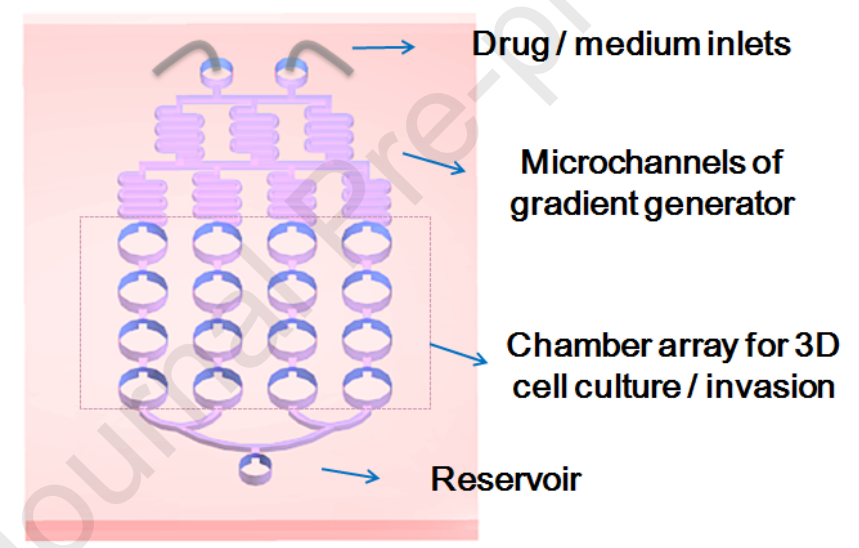
图1、用于GBM三维检测的集成微流控装置示意图
SNG162影响细胞生长。用SNG162 (1 μM、3 μM、5 μM)作用U87细胞24 h(图2),与对照组相比,不同浓度SNG162对U87细胞ER-α36的表达均有显著下调,且呈剂量依赖性。EGFR表达与ER-α36一致。由于ER-α36介导的E2诱导U87细胞增殖。
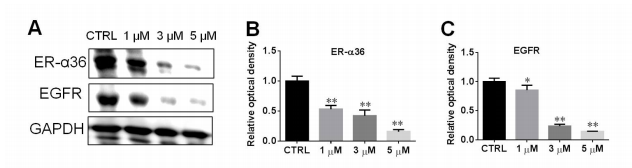
图2、SNG162下调ER-α36和EGFR表达,抑制U87细胞增殖
在不同浓度SNG162处理的U87细胞中,cyclinB、cyclinE、CDK4和cyclinD的表达均被抑制(图3)。
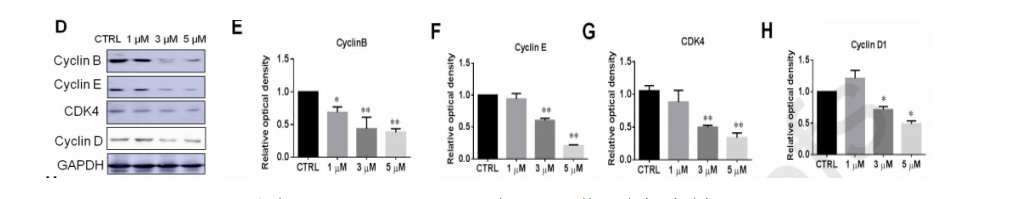
图3、SNG162下调细胞周期蛋白表达
如图4所示,经过不同浓度SNG162处理后,G0/G1和G2/M期的U87细胞数量增加,S期细胞数量明显减少。
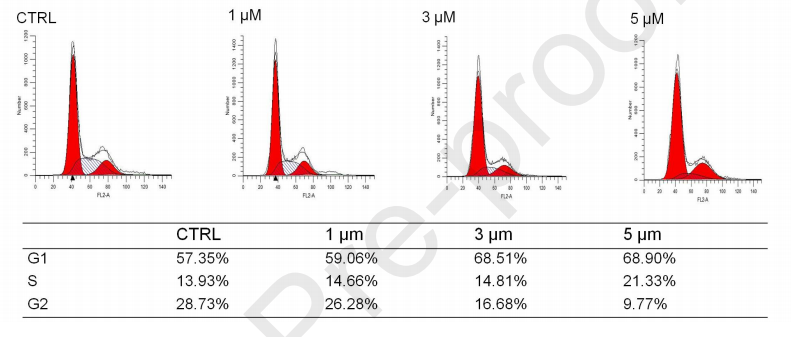
图4、SNG162对细胞周期进程的影响
U251细胞和U87细胞是两种常见的人类胶质瘤细胞系。作者实验室前期研究表明,ER-α36在U251细胞中的表达低于U87细胞。团队分别用不同浓度的SNG162处理U87和U251细胞。不管是处理24 h还是48h, SNG162均抑制了U87和U251细胞的活力,且对U251细胞的抑制作用更强(图5)。
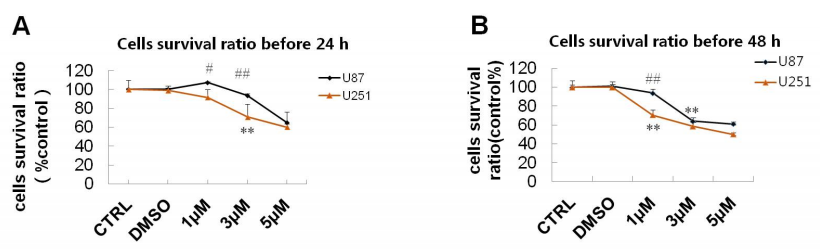
图5、SNG162对细胞生存率的影响
SNG162对细胞凋亡的影响与ER-α36的表达无关。应用不同浓度SNG162后,细胞存活率均有所下降,且U251细胞的存活率低于U87细胞(图6)。
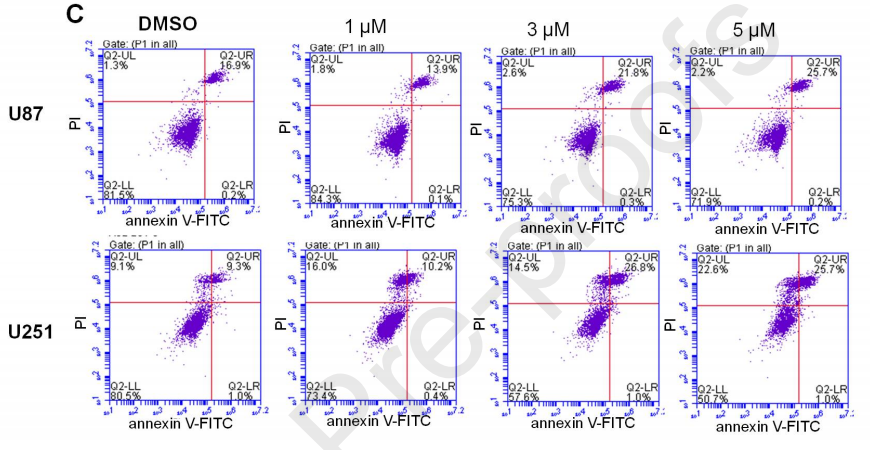
图6、SNG162对细胞凋亡的影响
前期研究发现低浓度E2通过ER-α36激活MAPK和AKT信号通路并且诱导U87细胞增殖。
本文检测了SNG162对E2诱导的U87细胞生长的影响。结果发现,1 μM SNG162处理后,各浓度的E2均未诱导细胞增殖;但与SNG162组相比,1 μM E2使细胞数量增加(图7A)。
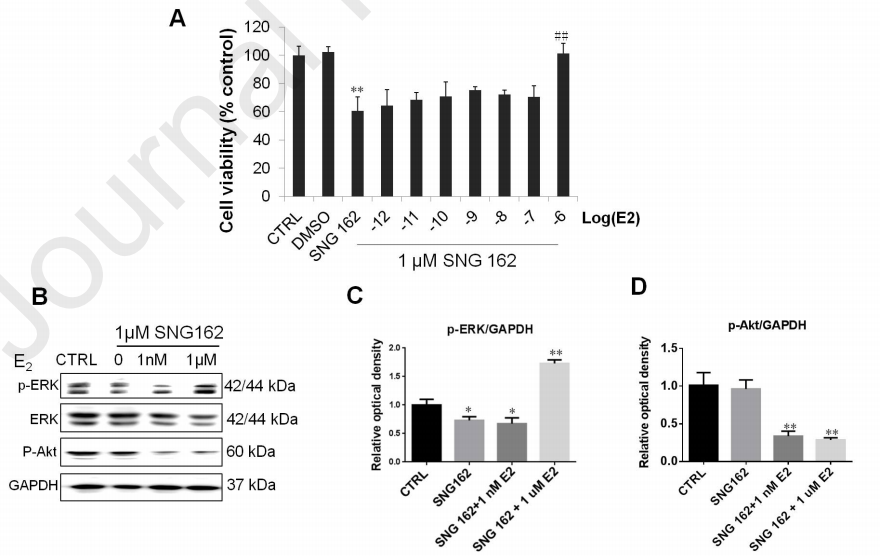
图7、SNG162对膜初始E2信号通路的影响
如图7B-D所示,与对照组相比,SNG162处理后,低浓度E2(1 nM )不激活MAPK信号,但高浓度 E2(1 μM)增加了MAPK磷酸化水平。另外,1 nM和1 μM E2均可降低AKT的磷酸化水平,SNG162本身并不影响U87细胞中AKT的活化。
以上结果表明,SNG162抑制ER-α36介导的U87细胞E2信号通路的激活。
为了验证SNG162是否能在模拟人体条件下抑制GBM细胞的存活,研究团队培养了细胞球体。
图8A-B显示,不同浓度的SNG162均能降低U87细胞存活率,增加细胞死亡率,且呈剂量依赖性。3.3 μM的SNG162促进了侵袭,较高浓度的SNG162降低了侵袭(图8A和8C)。
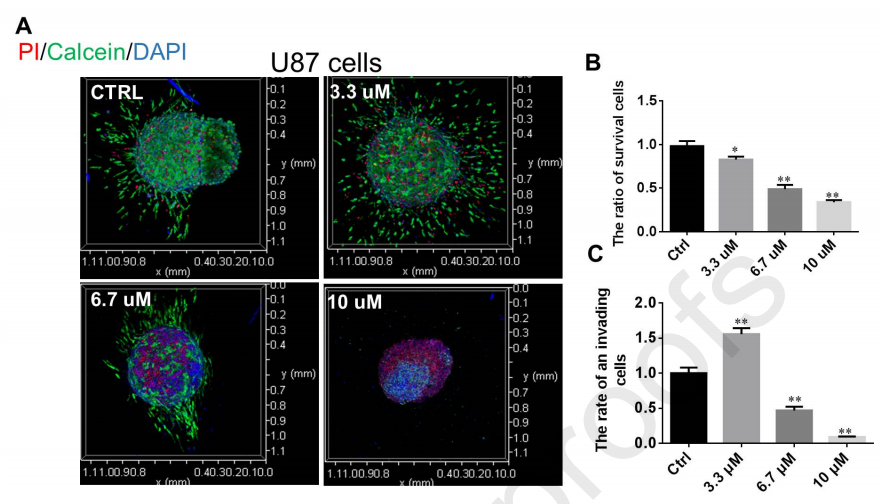
图8、SNG162对U87细胞存活和侵袭的影响
为了验证SNG162对ER-α36低表达的U251细胞的凋亡和侵袭的作用,采用微流控芯片装置处理细胞。如图9A-B所示,不同浓度的SNG162使死细胞和活细胞的比例呈剂量依赖性增加。这一发现与图6一致,其中U251细胞比U87细胞对SNG162更敏感。然而,SNG162没有抑制U251的侵袭(图9C)。
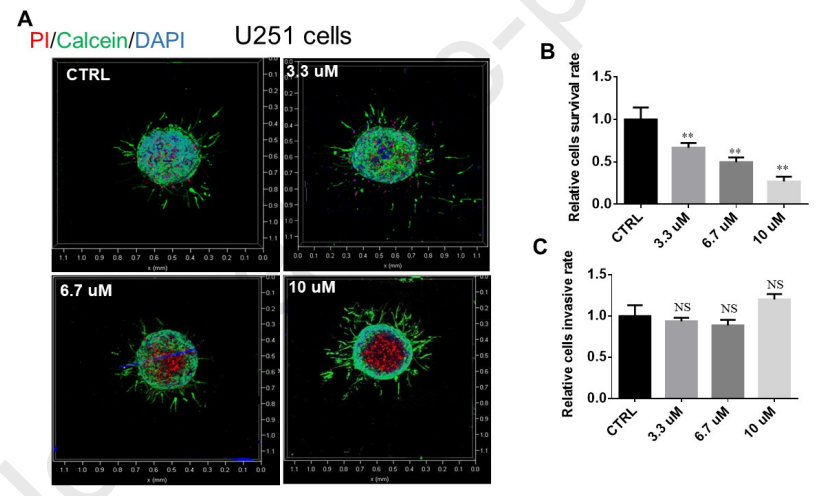
图9、SNG162对U251细胞存活和侵袭的影响
如图10A-B所示,在U87细胞中敲低ER-α36的表达,3.3 μM SNG162处理后,U87- 36KD细胞的存活率(0.493)依旧下降,且低于U87细胞(0.822)。提示SNG162对GBM细胞生长的抑制作用不依赖于ER-α36,且与SNG162的细胞毒性有关。
ER-α36参与了GBM细胞的侵袭,U87- 36KD细胞的侵袭性低于U87细胞。图10C显示,SNG162 (3.3 μM、6.7 μM、10 μM)对U87-36KD细胞侵袭有抑制作用,抑制率不随SNG162浓度的增加而增加。提示SNG162通过靶向ER-α36的表达来抑制GBM细胞的侵袭。
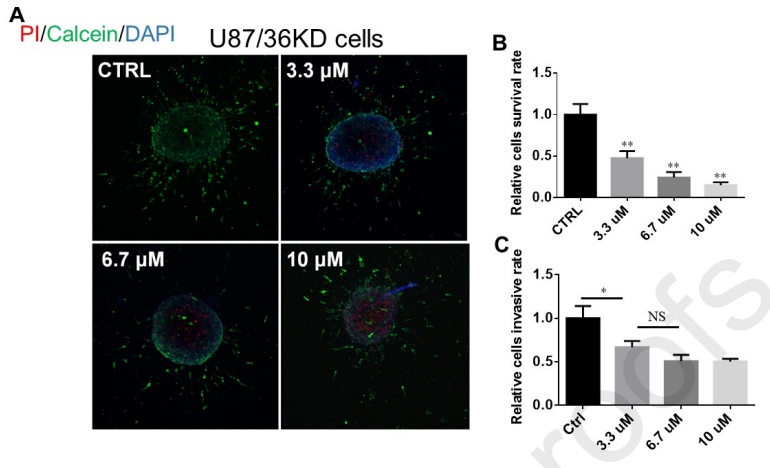
图10、SNG162对U87-36KD细胞存活及侵袭的影响
缺氧条件下SNG162靶向下调细胞核内ER-α36的表达。肿瘤微环境一般都是缺氧的,为了确定高浓度SNG162是否会下调缺氧条件下U87细胞ER-α36和EGFR的表达,通过微流体将不同浓度的SNG162 (3.3 μM、6.7 μM、10 μM)作用于U87细胞24 h。
如图11A-C所示,SNG162下调了整个细胞群ERα36和EGFR的表达。然而,比起在侵袭性细胞中,SNG162在非侵袭性细胞中更明显地抑制EGFR表达(图11D)。侵袭细胞中ER-α36主要在细胞核中表达(图11E)。
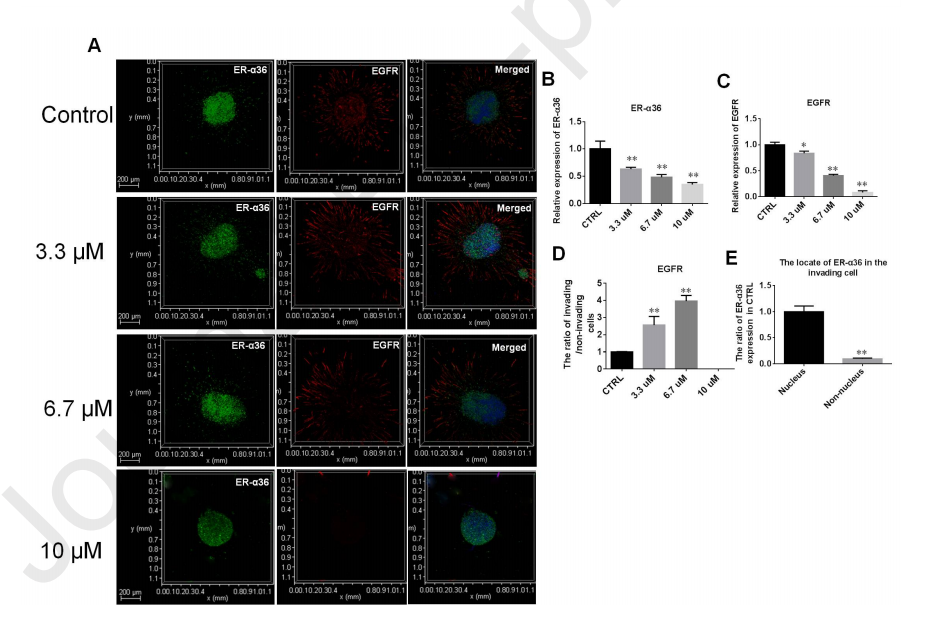
图11、高浓度SNG162抑制U87细胞核ER-α36的表达
ER-α36介导膜启动雌激素信号通路,促进细胞生长;然而,细胞膜上ER-α36的表达并不能决定GBM的恶性程度。作者采用微流控芯片技术培养GBM细胞球,首次分离出高侵袭性GBM细胞。结合共聚焦分析,作者发现ER-α36在高侵袭性GBM细胞的细胞核中表达。该调节因子特异性靶向细胞核内ER-α36表达的降低,显著抑制GBM侵袭性。靶向高侵袭性GBM结合传统治疗方法可能成为根治GBM、实现临床治疗的关键。