据世界卫生组织(WHO)统计,结直肠癌(CRC)是全球范围内发病率排名第三、致死率排名第二的癌症类型,给患者和社会带来了极大的健康危害和经济负担【1】。结直肠癌可能发生在任何年龄,但大多只影响50岁以上的老年人,年轻人群中结直肠癌的发病率很低。然而,近30年来,50岁以下的年轻人群中结直肠癌的发病率一直在上升。由于年轻人结直肠癌发病的增加,导致结直肠癌的平均诊断年龄从72岁提前到了66岁。而就在今日,《美国医学会杂志》(JAMA)发布的最新指南已经建议将结直肠癌的筛查起始年龄降至45岁。这进一步凸显了结直肠癌早筛的重要性。
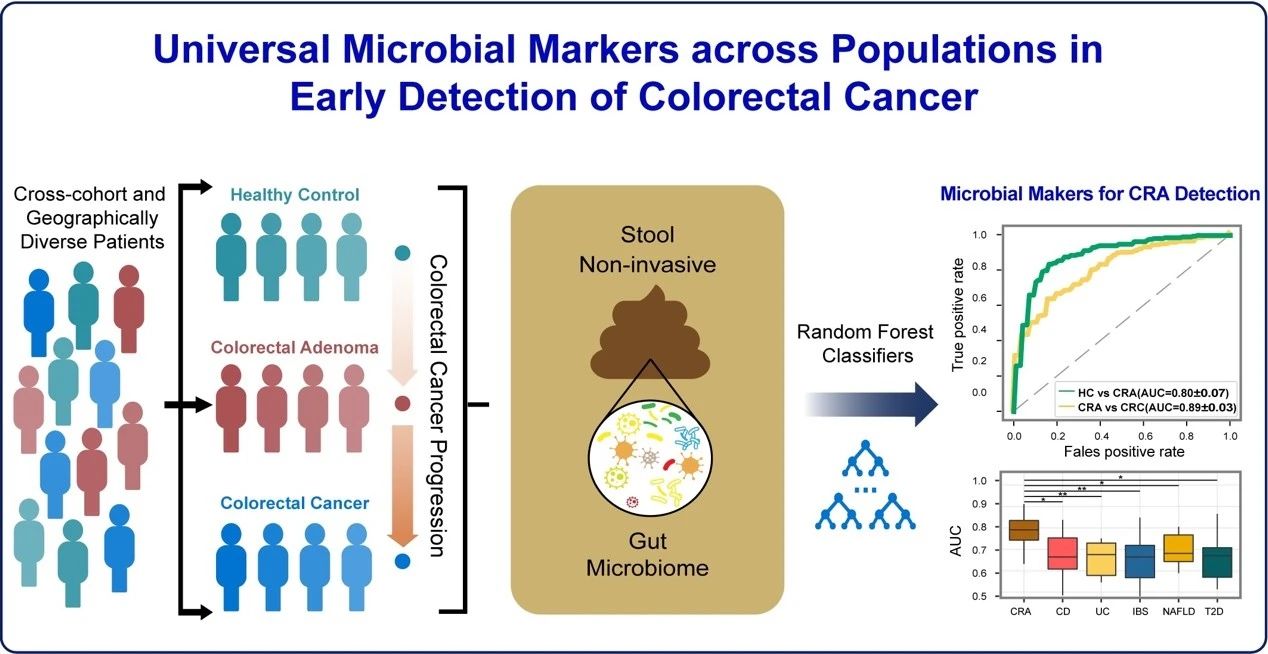
2021年5月24日,中山大学附属第六医院胃肠病研究所朱立新课题组等在 Nature 子刊 Nature Communications 在线发表了题为:Identification of microbial markers across populations in early detection of colorectal cancer 的研究论文。该研究实现了基于粪便微生物标志物的结直肠癌(CRC)真正早筛,即结肠腺瘤(CRA)阶段的筛查。
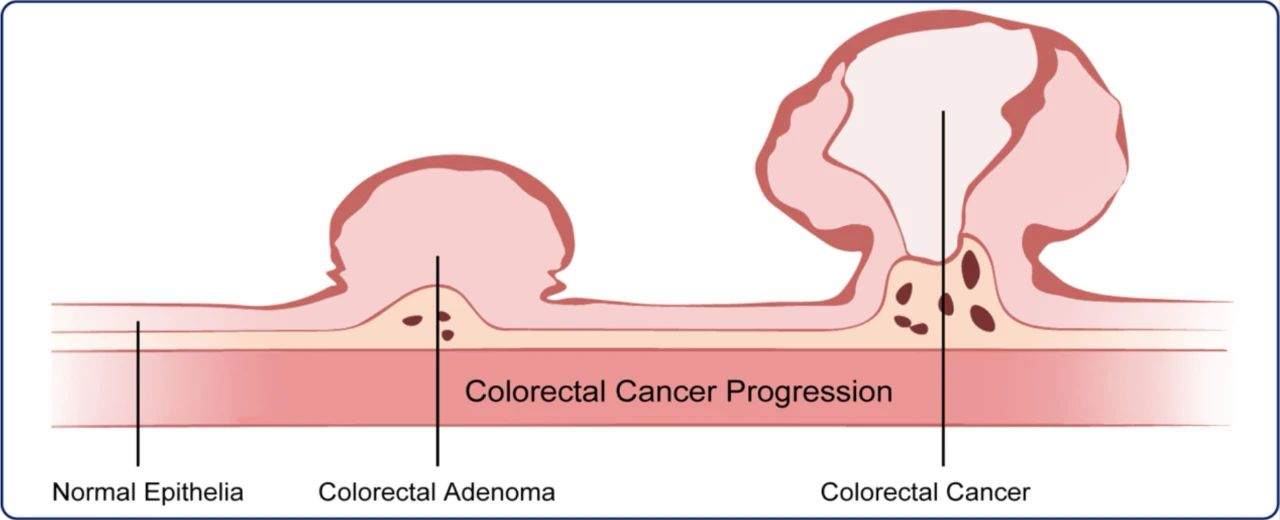
目前肿瘤的临床治疗手段仍然十分有限,治疗效果并不理想,肿瘤防治的核心仍是“早发现、早诊断、早治疗”。研究表明,对肿瘤患者在发病早期进行有效的筛查和早期干预,能显著提高患者的生存率(早期患者的5年生存率能达到90%),并节省医疗资源和时间【2】。因为结肠腺瘤(Colorectal Adenoma, CRA)是绝大多数CRC发生必经前体【3】(图1),因此,结肠腺瘤(CRA)阶段的筛查对结直肠癌(CRC)防治至关重要。
结直肠癌(CRC)的筛查已受到国家高度重视,然而现有筛查手段(比如传统的影像学、内镜和肿瘤标志物筛查,图2)存在放射性损害、有创、灵敏度较低和依从性过低等局限性,迫切需要技术革新。随着液态活检技术(无创)的日渐成熟,从血、尿和粪便样本中找寻合适的(分子)标记物已成为癌症筛查技术的主要发展方向。其中由于粪便是消化道代谢的直接产物,因此,对于消化道疾病,特别是结直肠癌(CRC),粪便样本相关检测被寄予厚望。粪便免疫化学检测(fecal immunochemical test, FIT)、粪便隐血检测(fecal occult blood test, FOBT)和现有的粪便微生物标志物检测在结直肠癌(CRC)的诊断中得到广泛应用。虽然这些方法技术对中晚期结直肠癌(CRC)筛查效果较好,但遗憾的是,对于早期结直肠癌(CRC)的,特别是结肠腺瘤(CRA)灵敏度仍然较差(图2)。

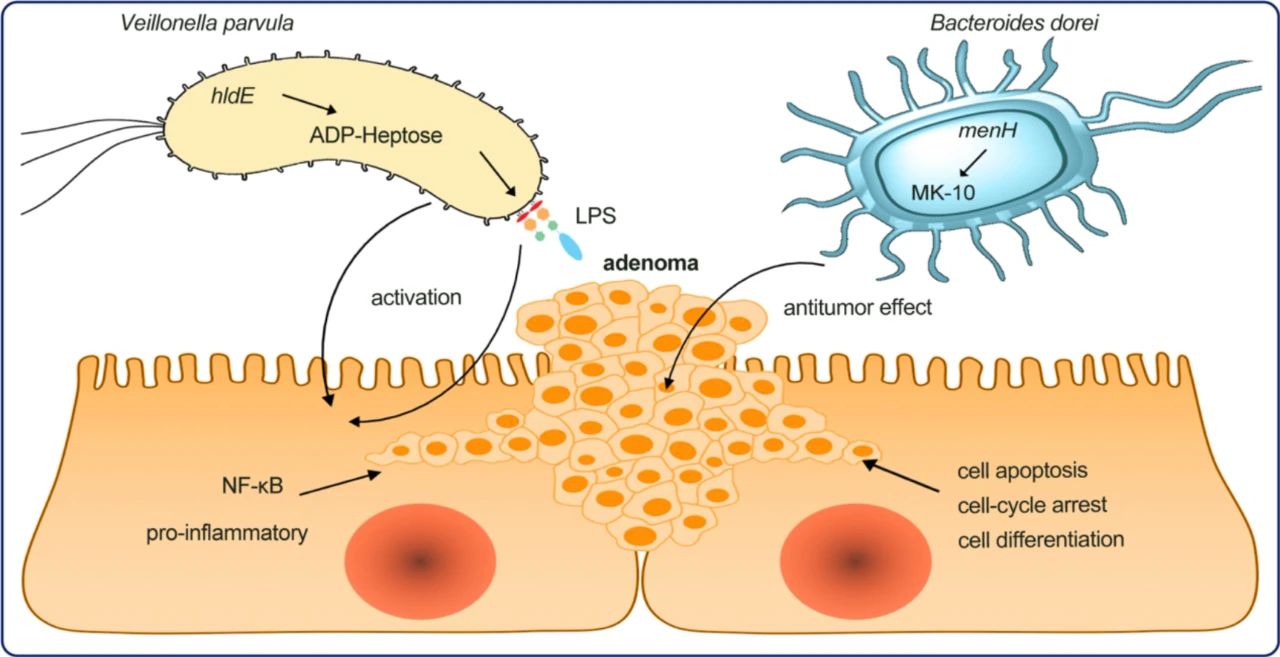
中山大学附属第六医院胃肠病研究所朱立新教授团队与其联合研究团队整合了来源于多个研究中心的健康对照、结肠腺瘤(CRA)和结直肠癌(CRC)共775例样本的粪便微生物测序数据,对基于微生物标记物的结直肠癌(CRC)早诊早筛进行了系统的研究。考虑到混杂因素(confounders)对研究结果的影响,该研究首先通过控制混杂因素去除批次效应,确定出结直肠癌(CRC)发展过程中显著性差异且在跨地域的队列中一致变化的细菌。随后,使用递归特征消除法(iterative feature elimination, IFE)筛选具有最强疾病分辨能力的菌种标志物,同时为避免模型的过拟合,本研究构建了10折交叉验证随机森林模型。最终,基于11个(e.g. Christensenellaceae R-7 group sp., Ruminococcaceae UCG-005 sp., Veillonella parvula)和26个(e.g. Streptococcus thermophilus TH1435, Bacteroides dorei, [Clostridium] scindens)细菌相关标志物分别构建了健康/CRA(AUC=0.80)和CRA/CRC(AUC=0.89)分类诊断模型。其中,健康/CRA模型较先前研究显著提高,例如:Thomas等研究表明由多种微生物构建的跨队列健康-腺瘤模型的AUC值仅为0.54【4】。此外,该模型的灵敏度为0.82,显著高于目前国内唯一获证的早筛IVD产品(诺辉健康的常卫清FIT-DNA检测,其腺瘤阶段早筛灵敏度为63.5%)【5】。进一步,本研究还通过队列间study-to-study和leave-one-dataset-out(LODO)分析证明了挑选出的标志物具有跨地域队列的通用性。更重要的,健康/CRA和CRA/CRC模型在两套独立队列(验证队列1:CRA患者102例,健康对照70例;验证队列2:CRA患者57例,CRC患者52例)中同样具有优良的表现,其中独立验证队列1的AUC值为0.78,独立验证队列2的AUC值为0.84。此外,本研究所挑选出的标志物能显著地区分其它肠道菌群密切相关疾病:如UC(P=0.045)、CD(P=0.003)、IBS(P=0.009)、NAFLD(P=0.027)和T2D(P=0.020),表明鉴定出的结肠腺瘤(CRA)肠道菌群标志物具有较高的疾病特异性。总体而言,本研究得到的癌症菌种标志物具有强大的结直肠癌(CRC)精准早诊早筛的潜力。进一步,本研究基于标记基因测序数据预测了微生物的潜在功能,发现:相对于健康状态,肠道菌群标志物Veillonella parvula参与的ADP-L-glycero-beta-D-manno-heptose(ADP-heptose)生物合成通路的丰度以及编码该通路关键酶hldE的基因表达在结肠腺瘤(CRA)中显著增加;进一步,相对于结肠腺瘤(CRA)状态,由肠道菌群标志物Bacteroides dorei参与的menaquinol-10(MK-10)生物合成通路丰度以及编码关键酶menH和menF基因的表达在结肠腺瘤(CRA)中显著增加(图3),该结果在新收集的独立队列中得到验证,为早期结直肠癌(CRC)的治疗提供了潜在靶点。