高血压大家都不陌生,中国高血压调查的最新数据显示,2012-2015年我国成人高血压患病率为27.9%,也就是说约每3位成人中就有1例高血压患者,同时患病率趋势总体还在持续走高。而且,高血压是冠心病(CHD)和中风的主要驱动因素,也是世界范围内致残和过早死亡的最重要原因。关于高血压发病机制的研究从未停止,肾脏是与血压调节、高血压和抗高血压治疗相关的关键器官。然而,目前我们对高血压易感性的遗传介导的肾脏机制仍然知之甚少。
近日,英国曼彻斯特大学Maciej Tomaszewski团队在国际一流学术期刊《自然—遗传学》上发表了题为“Uncovering genetic mechanisms of hypertension through multi-omic analysis of the kidney”的文章,通过肾脏多组学分析揭示高血压的遗传机制。

DOI: 10.1038/s41588-021-00835-w
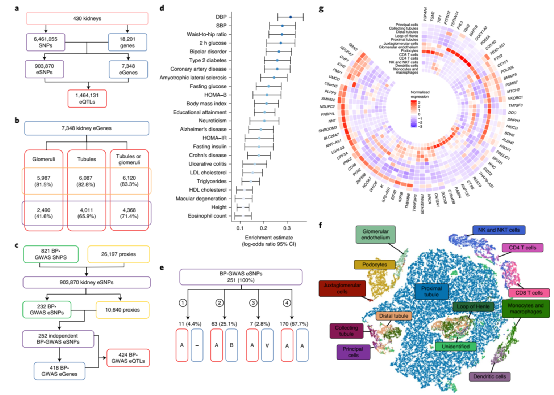
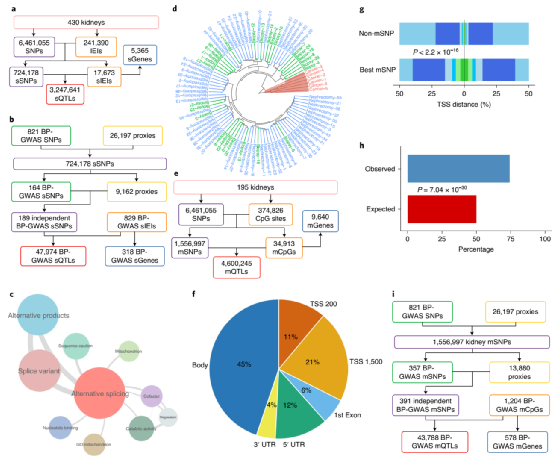
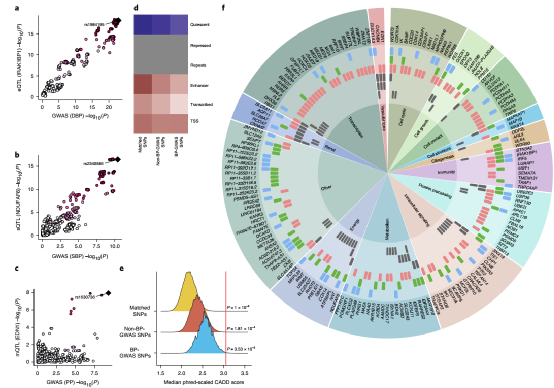
在这项研究中,研究团队利用选择性肾切除术后或肾移植前收集的样本建立了一个最大的人类肾脏资料库,整合了多达430个人类肾脏的基因型、基因表达、可变剪接和DNA甲基化图谱。其中肾脏的cis-eQTL分析(顺式-基因表达量定位分析)表明,人类肾脏中有大量的遗传效应存在转录水平操作。在血压相关全基因组关联分析(BP-GWAS)变异和肾脏基因表达研究中,研究团队发现了大约三分之一的BP-GWAS变异的基因表达靶点,并表征了它们的组织特异性,通过单细胞转录组学将这些基因定位到特定的细胞类型和人类肾元的功能隔间。人类肾脏的cis-eQTL分析和BP-GWAS中鉴定的遗传变异随后,研究人员探讨了肾脏基因选择性剪接和DNA甲基化与血压的关系,数据表明大约四分之一的BP-GWAS信号与肾脏中运行的选择性剪接机制相关,而且相当大比例的相关cis-sQTL(顺式-选择性剪接定位分析)不能通过cis-eQTL捕获。尽管BP-GWAS肾脏sGenes和sSNPs共同表现出一些参与选择性剪接的典型分子特征,但它们并不位于BP-GWAS前哨变异或经典剪接位点附近。这表明,BP和肾脏选择性剪接之间的大多数遗传关联是通过更复杂、微妙和遥远的调控元件和网络进行的。此外,研究人员在GWASs中检测到大量与BP相关的位点的肾脏DNA甲基化特征,并证明大约有一半位于转录起始位点附近的区域。表明这些基因在形成细胞和临床BP表型的调节过程中起作用。BP-GWASs中人肾脏及变异的顺式sQTL和顺式mQTL分析最后,研究人员分析了BP-GWAS与肾脏QTL信号的共定位以及肾eGenes、sGenes、mGenes及BP的MR分析,数据表明,大约三分之一的BP-GWAS位点包含一个共定位的肾脏QTL和BP-GWAS关联,这些信号富含功能性染色质注释和遗传毒性。而大约15%的GWAS信号可能是由肾脏基因在不同水平的分子调控(表达、选择性剪接或DNA甲基化)驱动的。这些基因中的绝大多数与BP、人类高血压或肾脏尚未建立起生理联系,但许多基因在心血管和肾脏系统中发挥着重要的生物学作用,其相关性尚不清楚。这意味着存在一种新的、不确定的调节网络,将BP和肾脏与人类健康和疾病的分子决定因素连接起来。总之,这项研究揭示了肾脏内嵌高血压的分子机制,将有助于今后以患者为中心的高血压诊断准确性的提高和新降压靶向策略的问世,加快精准医学的进展。
参考资料:
[1]https://www.nature.com/articles/s41588-021-00835-w。
文章来源:生物探索